中華預防醫學會出生缺陷預防與控制專業委員會新生兒篩查學組
中國醫師協會醫學遺傳醫師分會臨床生化遺傳專業委員會
中國醫師協會青春期醫學專業委員會臨床遺傳學組
選自中華兒科雜志, 2017,55(06)
葡萄糖-6-磷酸脫氫酶(glucose-6-phosphate dehydrogenase,G6PD)缺乏癥是由于紅細胞膜的G6PD缺陷,導致紅細胞戊糖磷酸途徑中谷胱甘肽還原酶的輔酶——還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)生成減少,使得維持紅細胞膜穩定性的還原型谷胱甘肽生成減少而不能抵抗氧化損傷,最終導致紅細胞破壞并溶血的一種遺傳病[1]。G6PD基因位于X染色體上,該病系X-連鎖遺傳疾病。患者常因食用蠶豆而發病,俗稱"蠶豆病",部分重型患者可引起新生兒期重度高膽紅素血癥,或在特定條件下(氧化應激、食物或藥物)誘發非免疫性溶血,危及生命。本病重在預防。
G6PD缺乏癥主要分布于東南亞、非洲、中東和地中海沿岸,全世界約4億人口受累,男性多于女性[2]。我國G6PD缺乏癥的分布呈南高北低趨勢,廣東、廣西、海南、云南、貴州等地區人群患病率高[2,3],隨著人口流動,患病率較低的地區也呈現增高趨勢。我國自1981年開展新生兒疾病篩查以來,多省市逐步增加了G6PD缺乏癥的篩查項目,但對于此病的新生兒篩查尚無共識。為了規范G6PD缺乏癥新生兒篩查的流程及后續的診斷和遺傳咨詢,由中華預防醫學會出生缺陷預防與控制專業委員會新生兒篩查學組、中國醫師協會醫學遺傳醫師分會臨床生化遺傳專業委員會和中國醫師學會青春期醫學專業委員會臨床遺傳學組組織專家討論,并達成以下共識。
【新生兒篩查】
1.G6PD缺乏癥新生兒篩查推薦開展地區:
世界衛生組織(WHO)建議在男性患病率>3%~5%的地區應常規開展G6PD缺乏癥的產前健康教育及新生兒篩查[4,5,6]。各地區應結合本地區的G6PD缺乏癥流行病資料及對公眾健康的危害程度,選擇性開展該項新生兒疾病篩查。
2.篩查方法及原理:
G6PD缺乏癥新生兒篩查主要是通過檢測干血濾紙片的G6PD酶活性完成,G6PD酶活性篩查方法主要包括熒光定量法或熒光斑點法,由于熒光定量法具有較高的特異性與靈敏性,因此新生兒篩查推薦使用該方法。
熒光定量法原理是干血濾紙片的G6PD作用于底物葡萄糖-6-磷酸(G-6-P)及煙酰胺腺嘌呤二核苷酸磷酸(NADP),將G-6-P氧化為6-磷酸葡萄糖酸(6-PG),同時將NADP還原為NADPH(圖1)[7,8],在特定激發波長(355 nm)和發射波長(460 nm)下檢測NADPH的熒光強度,計算G6PD酶的活性。該方法對于女性雜合子的診斷效率有限。
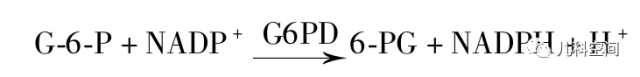
G6PD活性檢測原理
3.篩查流程及質量管理:
G6PD缺乏癥的新生兒篩查應嚴格遵循原衛生部2009年《新生兒疾病篩查管理辦法》、2010年《新生兒疾病篩查技術規范》及《醫療機構臨床實驗室管理辦法》衛醫發(2006)73號的要求執行,實施篩查全程質量管理,同時需注意以下事項:
(1)知情同意原則:知情同意書應包括篩查目的、方法及局限性,女性雜合子患者有漏篩可能,對于篩查陽性新生兒應早期確診并告知容易出現新生兒黃疸等注意事項。
(2)樣本采集與遞送:樣本采集和遞送應按照2010年《新生兒疾病篩查技術規范》執行,建議冷鏈(2~8 ℃)遞送樣本。
(3)優先檢測原則:由于G6PD酶活性容易受溫度、濕度及待檢時間等因素的影響,同時嚴重型G6PD缺乏癥新生兒有可能早期發病,故篩查樣本到達實驗室后,應優先于其他新生兒篩查的項目檢測。
(4)篩查陽性切值:各實驗室應參照試劑盒說明及本實驗室數據制定合理的陽性切值。熒光定量法切值多設定為2.1~2.6 U/g血紅蛋白。針對男、女新生兒設置不同的切值有助于女性雜合子的檢出[8,9]。
(5)陽性召回:對初篩陽性的新生兒召回后應直接進行診斷性檢查。
(6)在G6PD酶活性檢測前,需對血片遞送時間、標本保存條件等質控指標進行監控。在標本檢測后,需對陽性樣本召回率進行監控。
【實驗室確診方法】
對新生兒G6PD缺乏癥篩查陽性者需立即召回,進行診斷性G6PD酶活性檢測,推薦采用靜脈血紅細胞G6PD酶活性測定法或G6PD/6磷酸葡萄糖酸脫氫酶(6PGD)比值法進行確診。基因診斷也是可靠的確診方法,有條件的實驗室可同時開展[7]。
1.G6PD酶活性檢測:
常用的方法包括G6PD酶活性測定法和比值法。G6PD酶活性測定法的原理為樣本中G6PD催化G-6-P生成6-PG,同時將NADP變成NADPH,檢測340 nm吸光度的上升速率即NADPH生成速率,計算出樣本中G6PD酶活性。切值應根據所采用的試劑盒及實驗室具體情況確定[7]。比值法通過測定G6PD/6PGD比值對G6PD缺乏癥進行診斷,比值<1為G6PD缺乏,女性雜合子由于G6PD酶活性輕度降低,比值通常在1.0~1.3之間[10]。G6PD缺乏癥患者在急性溶血或在網織紅細胞升高時檢測G6PD酶活性,由于新生兒的紅細胞比例較高可能會導致酶活性測定出現假陰性,故對于嚴重溶血或輸血患兒,需10~15 d后重新采集測定。
根據G6PD酶活性水平以及G6PD缺乏癥臨床表現的有無及程度,WHO將G6PD酶活性分五個亞型[4,6]:(1)酶活性嚴重缺乏伴先天性非球形細胞溶血性貧血:酶活性接近0,在無明顯誘因下出現慢性溶血,藥物、感染、特殊食物等可誘發急性溶血,常引起新生兒高膽紅素血癥;(2)酶活性嚴重缺乏:酶活性低于正常的10%,藥物、感染、特殊食物等可誘發急性溶血;(3)酶活性輕中度缺乏:酶活性為正常的10%~60%,臨床癥狀輕重不一,藥物可誘發急性溶血;(4)酶活性輕度降低至正常:酶活性為正常的60%~150%,一般無臨床癥狀;(5)酶活性增高:酶活性可高于正常的150%,臨床無癥狀。G6PD缺乏癥患者的酶活性主要為1~3亞型。
2.基因診斷:
G6PD基因檢測是G6PD缺乏癥確診的重要依據,尤其對于女性雜合子、臨床疑似而生化診斷不明確或有家族史的患者。女性雜合子由于其X染色體可隨機失活,導致部分女性可發病。基因診斷常用檢測方法有Sanger測序、高分辨熔解曲線(high resolution melting, HRM)等DNA檢測技術。
G6PD基因位于Xq28,長約20 kb,包含13個外顯子,編碼515個氨基酸的蛋白酶,起始密碼子位于第2外顯子,第1外顯子不參與翻譯[1]。目前已報道的致病性變異有214種(http://www.hgmd.cf.ac.uk/ac/gene.php?gene=G6PD)。根據相關的表型(WHO建議的酶活性分類),將G6PD缺乏癥的致病性變異分為Ⅰ~Ⅳ類,Ⅰ類致病性變異導致酶活性嚴重缺乏伴先天性非球形細胞溶血性貧血,主要位于外顯子6、10和13,這些致病性變異所編碼的氨基酸多位于底物結合區、NADP+輔酶結合區等重要結構域。Ⅱ類致病性變異導致酶活性嚴重缺乏;Ⅲ類致病性變異導致酶活性輕中度缺乏;Ⅳ類致病性變異導致酶活性輕度降低或正常(主要為外顯子5和9的致病性變異)。大部分導致G6PD缺乏癥的致病性變異屬于Ⅰ、Ⅱ、Ⅲ類,極少數為Ⅳ類[11]。
我國人群中已發現的G6PD致病性變異超過30種,絕大多數屬Ⅱ類或Ⅲ類,分布有種族和地區特異性[11,12,13]。我國常見的致病性變異有9種,分別為c.95A>G(p.His32Arg)、c.392G>T(p.Gly131Val)、c.487G>A(p.Gly163Ser)、c.493A>G(p.Asn165Asp)、c.592C>T(p.Arg198Cys)、c.1024C>T(p.Leu342Phe)、c.1360C>T(p.Arg454Cys)、c.1376G>T(p.Arg459Leu)和c.1388G>A(p.Arg463His),這9種變異占總變異的90%以上,而其中c.95A>G(p.His32Arg)、c.1376G>T(p.Arg459Leu)和c.1388G>A(p.Arg463His)3種類型最常見,約占總變異的70%~80%[2,12]。因此,基因診斷推薦首先進行熱點變異檢測的策略。
【臨床表現】
G6PD缺乏癥患者臨床表現差異大,大部分患者終身可無臨床癥狀,在不發病的情況下,該病通常不影響壽命及生活質量,僅小部分患者在食物、藥物、感染誘發G6PD缺乏癥下出現發作性溶血性貧血,甚至表現為自發性慢性非球形細胞性溶血性貧血。急性溶血期常見的臨床表現包括有乏力、面色蒼白、黃疸、腰痛,實驗室檢測提示非結合膽紅素升高,血紅蛋白降低,網狀紅細胞增多,血紅蛋白尿等。G6PD缺乏癥臨床表現可分為以下幾種表型[14,15]:
1.新生兒高膽紅素血癥:
G6PD缺乏癥是新生兒高膽紅素血癥常見和重要的危險因素[16,17],同時也是G6PD缺乏癥高發區新生兒膽紅素腦病的主要病因。G6PD缺乏癥導致的新生兒高膽紅素血癥多發生于出生后2~4 d,也可提前至生后24 h內,以中重度多見,容易引起膽紅素腦病,早產兒重于足月兒。新生兒G6PD缺乏導致黃疸的臨床表現與遺傳、環境等因素有關,例如G6PD缺乏同時合并尿苷二磷酸葡萄糖醛酸轉移酶(UGT1A1)缺陷可加重黃疸;產婦若使用了禁用、慎用氧化類藥物、中草藥,可通過乳汁誘發或加重新生兒黃疸,新生兒的衣物用樟腦丸(萘)存放過,也可誘發溶血。
2.食物、藥物或感染誘發的急性發作性溶血:

表1 G6PD缺乏癥禁用及慎用的部分藥物a |
食物、藥物或感染誘發的急性發作性溶血臨床表現為全身不適、乏力、發熱、寒戰、血紅蛋白尿、黃疸、貧血,重者可在短期內出現溶血危象、急性腎功能衰竭,危及生命。溶血多為自限性,時間一般持續1~2 d,長者可達10 d。在臨床上常難預測某種藥物是否會誘發G6PD缺乏癥個體急性溶血發作,溶血的發生與個體的藥代動力學差異、健康狀況、是否合并其他疾病如感染,以及同時使用其他藥物有關。
3.自發性慢性非球形細胞性溶血性貧血:
也稱為"先天性非球形紅細胞溶血性貧血",是G6PD缺乏癥的少見臨床表型,通常在嬰兒期或兒童期被診斷,表現為慢性自發性血管內、外溶血(血管外溶血為主),紅細胞中持續Heinz小體陽性,中重度貧血,或持續溶血性貧血,黃疸,肝脾腫大。發病年齡越小,病情越重。外源性誘因可并發急性發作性溶血,加重病情。
G6PD缺乏癥除了要與新生兒期常見ABO、Rh溶血癥鑒別外,尚需與其他自身免疫性溶血性貧血、陣發性睡眠性血紅蛋白尿以及少見的紅細胞酶缺陷導致的溶血性貧血疾病(如己糖激酶缺陷、丙酮酸激酶缺陷等)相鑒別。
【治療及預防】
1.治療:
患兒在無溶血發作時無需特殊治療。當出現急性溶血時,應立即阻斷誘因,并對癥治療。當合并慢性溶血性貧血時,應根據貧血程度選擇相應治療,嚴重貧血可輸入G6PD活性正常的紅細胞或全血。對達到病理性黃疸的新生兒,應根據膽紅素水平及個體情況,給予藥物、藍光或換血治療,預防新生兒膽紅素腦病的發生,其中藍光治療是最常用的安全有效的方法,能有效降低外周血膽紅素濃度[18,19]。
2.預防:
在高發地區應常規開展G6PD缺乏癥的新生兒篩查。對于G6PD缺乏癥患者及家屬須及時給予健康教育,避免進食干鮮蠶豆及其制品,避免接觸樟腦丸等日用品,尤其避免使用禁用、慎用氧化類藥物(表1)。當出現急性溶血時,應立即停止接觸和攝入可疑食物、藥物,并按急性溶血性貧血的處理原則進行治療。
【遺傳咨詢】
G6PD缺乏癥屬X-連鎖不完全顯性遺傳病,因此,如父親G6PD缺乏,母親正常(非雜合子),則男性胎兒正常,女性胎兒為雜合子。如父親G6PD缺乏,母親為雜合子,則男性胎兒半合子的概率為1/2,正常的概率為1/2;女性胎兒純合子概率為1/2,雜合子的概率為1/2。如父親G6PD缺乏,母親為純合子,男性胎兒均為半合子,女性胎兒均為純合子。如父親正常,母親為雜合子,則男性胎兒半合子和女性胎兒雜合子概率均為1/2。如父親正常,母親為純合子,男性胎兒均為半合子,女性胎兒均為雜合子[2]。
G6PD酶活性檢測能夠檢出絕大多數男性半合子及女性純合子的G6PD缺乏癥,但女性雜合子,尤其是酶活性位于切值附近,需通過基因診斷來明確。雖然本病為遺傳性疾病,但屬可預防臨床癥狀發作的疾病,一般不必要對胎兒進行產前診斷。在疾病高發地區可開展G6PD缺乏癥的產前酶活性篩查,為育齡人群提供G6PD缺乏癥的宣傳教育和遺傳咨詢[14],尤其是父母雙方或一方為G6PD缺乏癥患者或攜帶者,新生兒出生后應盡快行末梢血或臍血G6PD缺乏癥的篩查或診斷性檢測[14]。
本共識旨在為G6PD缺乏癥的新生兒篩查及診斷、遺傳咨詢提供參考。通過在G6PD缺乏癥的高發地區常規開展產前健康教育,提高新生兒篩查的覆蓋率,預防和降低新生兒嚴重高膽紅素血癥,尤其是膽紅素腦病的發生。
(范歆 邱文娟 鄒琳 黃永蘭 執筆)
參加本共識制定單位及人員
參加本共識制定單位及人員(按姓氏拼音排序):廣西壯族自治區婦幼保健院(范歆);上海交通大學醫學院附屬新華醫院(顧學范、邱文娟);廣州市婦女兒童醫療中心(黃永蘭);廣東省婦幼保健院(江劍輝);湖南省婦幼保健院(王華);海南省婦幼保健院(王潔);國家衛生計生委臨床檢驗中心(王治國);深圳市婦幼保健院(文偉);浙江大學醫學院附屬兒童醫院(楊茹萊、趙正言);濟南市婦幼保健院(鄒卉);重慶醫科大學附屬兒童醫院(鄒琳)


